Grafite, fórmula molecular: C, peso molecular: 12,01, é uma forma de elemento carbono, cada átomo de carbono é conectado por três outros átomos de carbono (organizados em hexágonos de favo de mel) para formar uma molécula covalente. Como cada átomo de carbono emite um elétron, aquele que pode se mover livremente, o grafite é um condutor.
A grafite é um dos minerais mais macios e seus usos incluem a fabricação de minas de lápis e lubrificantes. O carbono é um elemento não metálico localizado no grupo IVA do segundo ciclo da tabela periódica. A grafite é formada em altas temperaturas.
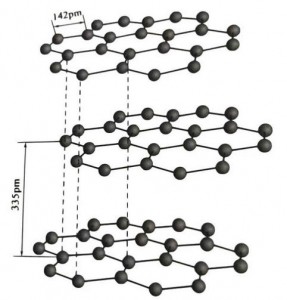
A grafite é um mineral cristalino de elementos de carbono e sua estrutura cristalina é uma estrutura hexagonal em camadas. A distância entre cada camada de malha é 3,35A e o espaçamento dos átomos de carbono na mesma camada de malha é 1,42A. É um sistema de cristal hexagonal com clivagem completa em camadas. A superfície de clivagem é composta principalmente por ligações moleculares, menos atrativas para as moléculas, portanto sua flutuação natural é muito boa.
Nos cristais de grafite, os átomos de carbono na mesma camada formam uma ligação covalente com hibridização sp2, e cada átomo de carbono está conectado a três outros átomos em três ligações covalentes. Os seis átomos de carbono formam um anel seis contínuo no mesmo plano, estendendo-se em uma estrutura lamelar, onde o comprimento da ligação CC é 142pm, que está exatamente dentro da faixa de comprimento da ligação do cristal atômico, portanto, para a mesma camada , é um cristal atômico. Os átomos de carbono no mesmo plano têm uma órbita p, que se sobrepõem. Os elétrons são relativamente livres, equivalentes aos elétrons livres nos metais, portanto a grafite pode conduzir calor e eletricidade, o que é característico dos cristais metálicos. Assim também classificados como cristais metálicos.
A camada intermediária do cristal de grafite é separada por 335 pm e a distância é grande. É combinada com a força de van der Waals, ou seja, a camada pertence ao cristal molecular. No entanto, como a ligação dos átomos de carbono na mesma camada plana é muito forte e extremamente difícil de destruir, o ponto de dissolução da grafite também é muito elevado e as suas propriedades químicas são estáveis.
Tendo em conta o seu modo de ligação especial, não pode ser considerado como um único cristal ou policristal, a grafite é agora geralmente considerada como um cristal misto.
Horário da postagem: 31 de julho de 2023